铜的化学性质
铜位于第四周期第ⅠB族,电子排布式为:1s22s22p63s23p63d104s1,铜是一种亮红色的固体,具有良好的导电导热性。铜在化学反应中易失去两个电子形成+2价。
铜的化学性质比较稳定,一般不与其他物质发生化学反应,利用铜的这一性质,古代人用铜制作货币。但铜在特定的条件下,也能被许多氧化性物质所氧化。
1、铜在加热条件下与O2、S、Cl2等非金属单质化合:
2Cu+O2 2CuO;2Cu+S Cu2S;Cu+Cl2 CuCl2
在潮湿空气中还可发生腐蚀生成绿色的铜锈:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
2、铜与非氧化性酸一般不反应,但与强氧化性酸,则可以发生氧化还原反应,但无H2产生:如:Cu+2 (浓) CuSO4+SO2↑+2H2O
3、铜还可以与某些盐溶液反应:如:
2FeCl3 +Cu=2FeCl2+CuCl2;Cu+2AgNO3 =Cu(NO3)2 +2Ag
4、铜的冶炼:工业上,主要采用高温冶炼黄铜矿的方法获得铜。这种方法冶炼的铜,其含量为99.5%~99.7%,还有Ag、Au、Fe、Zn等杂质。要达到电气化生产铜的要求,这种由黄铜矿高温冶炼的铜还必须经过电解精炼,电解精炼得到的铜,其含量高达99.95%~99.98%。
5、铜及其化合物的相互转化关系:
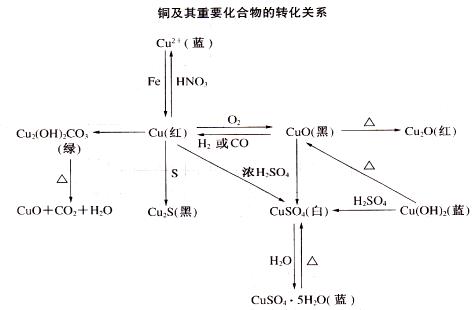
说明:
1、铜在和强氧化性物质如:X2、O2等反应时生成+2价,而在和S等弱氧化性物质反应时,则生成+1价。铜可以和强氧化性酸反应,但不能与H+作用;
2、CuO在高温下可以分解产生Cu2O和O2。在用H2还原CuO时,也可能产生少量的Cu2O(红色)。在有H+存在时不稳定:Cu2O+2H+=Cu2++Cu+H2O,利用这一性质,可鉴别H2还原CuO的产物中是否存在Cu2O;
3、铜可以与多种物质形成络合物,CuCl2在水溶液中存在如下平衡:[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O,当浓度较大时,平衡正向移动,[CuCl4]2-增大,显绿色,浓度较稀时,平衡逆向移动,溶液显蓝色。向Cu2+溶液中加入氨水,先生成蓝色沉淀,继续加入氨水,生成深蓝色溶液:
Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O
4、新制的Cu(OH)2可以和含有醛基的物质作用产生砖红色的Cu2O,利用这一性质可以鉴别含有醛基的物质。
CH3CHO+2Cu(OH)2→CH3COOH+Cu2O+2H2O
5、铜原子容易失去一个电子形成亚铜离子(Cu+)或失去两个电子形成铜离子(Cu2+),故铜形成化合物是以呈现一价或二价的氧化状态进行,但由正二价氧化状态形成的化合物比由正一价氧化状态形成的化合物稳定。
相关链接 >>
上一篇:铜的化合物
下一篇:铜的物理性质






 sales@chinatungsten.com
sales@chinatungsten.com