硅的介绍
元素符号:(Si)
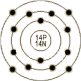
原子序数:(14)
相对原子质量: 28.0855
原子结构: 原子半径/Å: 1.46
原子体积/cm3/mol: 12.1
共价半径/Å: 1.11
电子构型: 1s2 2s2p6 3s2p2
离子半径/Å: 0.4
氧化态: 4
电子模型:
发现:1824 在瑞典,斯德哥尔摩, 由 J.J. Berzelius 发现。
来源:硅是第二个最丰富的元素,在地可中含25%,是构成粘土、沙、花岗岩和石英的主要成分。
用途: 用于制造玻璃,太阳能电池,水泥和半导体等等
物理性质:
| 熔 点(℃) | 沸 点(℃) | 密度(g/cc,300K) | 比 热/J/gK | 蒸发热/KJ/mol | 熔化热/KJ/mol | 导电率/106/cm | 导热系数/W/cmK |
| 1410 | 2355 | 2.33 | 0.71 | 384.22 | 50.55 | 2.52E-12 | 1.48 |
状态:硬的深灰色非金属。
地质数据:
丰 度 滞留时间/年: 30 000
太阳(相对于 H=1×1012): 4.47 × 107 海水中/p.p.m.
地壳/p.p.m.: 277 100 大西洋表面: 0.03 太平洋表面: 0.03
大西洋深处: 0.82 太平洋深处: 4.09
生物数据:
人体中含量
| 肝/p.p.m. | 肌肉/p.p.m. | 血/mg dm-3 | 骨/p.p.m | 日摄入量/mg | 人(70Kg)均体内总量/g |
| 12 - 120 | 100 - 200 | 3.9 | 1.7 | 18 - 1200 | c. 1 |
上一篇:什么是硅
下一篇:硅的应用






 sales@chinatungsten.com
sales@chinatungsten.com